TOTAL SINTESIS MITOMYCIN
Mitomycin adalah antikanker (sitotoksik) obat.Kanker terbentuk ketika beberapa sel dalam tubuh berkembang biak tak terkendali dan normal. Ada dua jenis kanker. kanker padat dimana bentuk benjolan misalnya tulang, otot, otak membagi dll dan berkembang biak sel-sel norma. Tipe kedua adalah penyakit leukemia lain dan limfoma di mana sel-sel darah abnormal membelah dan berkembang biak. karakteristik lain dari kanker selain pertumbuhan tidak terkendali mencakup kemampuan sel-sel abnormal untuk menyerang jaringan lain di samping mereka atau untuk melepaskan diri dari situs aslinya, perjalanan melalui darah atau getah bening, dan membentuk kanker baru di situs yang berbeda dari tubuh. Ini disebut metastasis.
Anthracycline adalah antibiotik anti-tumor yang mengganggu enzymes involved dalam
replikasi DNA. Obat ini bekerja di semua fase siklus sel. Salah satu anthracycline merupakan senyawa mitomycin. Terdapat dua
jenis mitomycin yang telah diisolasi dari Streptomyces caesipitorus, yaitu :
Mekanisme reaksi
mitomycin sebagai obat antikanker adalah berikatan dengan DNA tumor sehingga
replikasi DNA dari tumor terganggu dan lama kelamaan akan mati. Berikut ini
adalah mekanisme reaksinya :
Senyawa mitomycin dapat
disintesis di laboratorium dengan menggunakan pendekatan kishi, dimana pada
pendekatan kishi ini, menyatakan bahwa mitomycin dapat disintesis menggunakan
precursor sederhana awalnya orto-dimetoksi toluene. Berikut ini adalah
mekanisme reaksi pendekatan kishi senyawa mitomycin :
Berikut ini adalah
mekanisme reaksi sintesis senyawa mitomycin berdasarkan pendekatan khisi-nya yang
meliputi beberapa tahapan, yaitu :
a. Pembentukan senyawa intermediet aromatik
Berdasarkan gambar diatas, dapat dijabarkan
mekanisme reaksinya, yaitu sebagai berikut :
- Tahap I
Pada tahap ini, TiCl4 bertindak sebagai katalis asam (karna mengikat 4 Cl) dan dikloro metoksimetana sebagai reagennya. Gugus metoksi pada senyawa orto-diklorotoluena merupakan pengarah orto-para sehingga substituen dikloro metoksi metana akan tersubstitusi pada posisi orto. Selanjutnya Cl akan lepas karna adanya katalis TiCl4 sehingga menyebabkan O menjadi rangkap dan akan mendesak metil lepas dan terbentuk aldehid.
- Tahap II
Pada tahap ini digunakan reagen mCPBA (metacloroperoksibenzoit acid) yang merupakan reagen yang mudah menjadi radikal seperti pada gambar dibawah ini :
Karna
berikatan dengan suatu radikal, sehingga menyebabkan senyawa yang
terbentuk menjadi radikal pula, seperti
pada gambar berikut ini :
Setelah
itu radikal-radikal tersebut akan bereaksi membentuk senyawa berikut ini :
- Tahap III
Pada tahap ini, terjadi 3 step yaitu yang pertama
menggunakan reagen NaOMe, yang kedua menggunakan reagen MeOH yang menghasilkan
senyawa ester dan yang ketiga menggunakan air untuk menghidrolisis ester dan
menghasilkan gugus hidroksi atau senyawa orto-dimetoksi meta-hidroksi toluene.
- Tahap IV
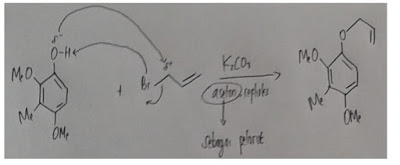
Pada tahap ini terjadi reaksi substitusi elektrofilik
dari 3-bromo-1-propena, H yang terikat pada O akan berikatan dengan Br- sehingga
propena akan tersubstitusi pada O.
- Tahap V

Pada tahap ini, terjadi delokalisasi membentuk keton
yang selanjutnya terjadi reaksi reduksi menghasilkan senyawa
2,6-dimetoksi-3-hidroksi-4-alil-toluena. Setelah terbentuk senyawa
2,6-dimetoksi-3-hidroksi-4-alil-toluena terjadi beberapa reaksi yang dijelaskan
pada gambar berikut ini :
- Tahap VI

- Tahap VII

Pada
tahap ini, digunakan Zn sebagai reduktor.
- Tahap VIII
Pada
tahap ini, dimasukkan N-benzilamin (Bn) yang berfungsi sebagai gugus pelindung
pada hidroksi.
- · Tahap IX
Selanjutnya adalah pembentukkan epoksida dari
dioksan, seperti yang dijelaskan pada gambar berikut ini :
- Tahap X
Pada tahap ini, cincin epoksida membuka dan disubstitusi
olen CH3CN dan menyebabkan O kekurangan elektron sehingga
ditambahkan CrO3- sehingga menghasilkan keton.
b. Pembentukan cincin medium
- Tahap I

Pada
tahap ini terjadi reaksi substitusi –OMe.
- Tahap II
Pada
tahap ini, CN direduksi oleh LAH menjadi NH2
- Tahap III
Pada tahap ini, gugus pelindung Bn
dihilangkan dengan menggunakan katalis Pd, karbon untuk menyerap air dan
methanol untuk mengasamkan. Hal ini diilustrasikan pada gambar berikut ini :
- Tahap IV
Pada tahap selanjutnya adalah dengan mengoksidasi
senyawa yang telah didapat dan menggunakan metanol sebagai pelarut, reaksinya
adalah sebagai berikut :
c. Siklisasi transannular
Pada tahap ini, terbentuk cincin siklik baru dari
gugus NH dengan 2 jalan, yang pertama dengan menggunakan MeOH dan SiO2
dan jalan yang kedua adalah dengan menggunakan gugus S-Me dan Et3N seperti
yang dijelaskan pada gambar berikut ini :
Berikut ini adalah reaksi siklisasi dengan
menggunakan jalur pertama menggunakan MeOH dan SiO2 yaitu sebagai
berikut :